1. Materi Redoks 1...Klik Disini
2. Materi Redoks 2..Klik Disini
3. Materi Redoks 3....Klik Disini
4. Materi Redoks 4...Klik Disini
5. Materi Redoks 5...Klik Disini
6. Materi Redoks 6...Klik Disini
BIMBINGAN BELAJAR "GRAND"
1. JL Raya Kampung Melayu Barat no.7 Ruko 1 Teluk Naga, Tangerang 15510..Telp 021 (55931107) 2. Jl. Soleh Ali Sukasari-Tangerang 155118..Telp 021(55791510) Alamat blog : bimbelgrandtangerang.blogspot.com.
Senin, 11 April 2016
Jumat, 08 April 2016
Cermin Cekung dan Cermin Cembung (Fisika)
Contoh soal dan pembahasan cermin cembung dan cermin cekung / cermin
lengkung materi fisika SMA kelas 10. Jarak bayangan, perbesaran, sifat
bayangan.
Untuk rumus-rumus kedua cermin lengkung di atas, disini disatukan saja sebagai berikut dan perhatikan ketentuan-ketentuan yang digunakan:
Jarak titik fokus, jarak bayangan dan jarak benda.

dimana:
s = jarak benda
s' = jarak bayangan
f = jarak titik api atau titik fokus cermin
Sedangkan untuk perbesaran bayangan

dimana
M = perbesaran bayangan
h = tinggi bendanya
h' = tingg bayangannya
Perhatikan juga ketentuan yang dipakai:

Catatan:
Untuk lensa, berlaku kebalikannya. Jadi lensa cembung fokusnya positif, lensa cekung negatif. Sementara untuk letak bendanya

Soal No. 1
Sebuah benda yang tingginya 4 cm berada 8 cm di depan sebuah cermin cekung. Jika panjang jari-jari kelengkungan cermin cekung 12, tentukan:
a) jarak bayangan
b) perbesaran bayangan
c) tinggi bayangan
d) sifat bayangan
Pembahasan
Jarak titik fokus adalah setengah dari jari-jarinya.
Data:
Cermin Cekung
f = 1/2 × 12 = 6 cm
s = 8 cm
h = 4 cm
a) jarak bayangan
Masukkan datanya

Atau dengan rumus yang sudah jadi

b) perbesaran bayangan

c) tinggi bayangan
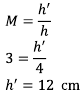
d) sifat bayangan
- nyata (s' bertanda positif)
- terbalik
- terletak di depan cermin
- diperbesar (karena M > 1)
Soal No. 2
Sebuah benda diletakkan di depan cermin cembung sejauh 20 cm yang jarak fokusnya 30 cm. Letak dan sifat bayangan yang dibentuk cermin tersebut adalah....
A. 60 cm di depan cermin, maya, tegak
B. 60 cm di belakang cermin, nyata, tegak
C. 60 cm di depan cermin, nyata, tegak
D. 12 cm di belakang cermin, maya, tegak
E. 12 cm di depan cermin, nyata, tegak
Pembahasan
Data soal:
Cermin cembung.
f = − 30 cm
s = 20 cm
Menemukan jarak bayangan dulu beserta tandanya:

atau

s' bertanda negatif, sehingga maya, tegak. Jaraknya 12 cm di belakang cermin. Jawaban D.
Soal No. 3
Sebuah benda berada 15 cm di depan cermin cekung yang memiliki titik fokus sejauh 12 cm. Dengan metode penomoran ruang, tentukan sifat-sfat bayangan yang terbentuk!
Pembahasan
Metode penomoan ruang digunakan untuk cermin cekung, dan lensa cembung. Berikut penjelasannya:

Untuk gambar ini, bagian depannya di sebelah kiri, belakangnya sebelah kanan.
Antara titik O dan titik F adalah ruang I
Antara titik F dan titik 2F adalah ruang II
Setelah titik 2F ke sana lagi adalah ruang III
Ruang IV berada di seberang, lihat gambar di atas.
Jumlah nomor ruang tempat benda dengan nomor ruang tempat bayangan adalah lima. Misalkan benda di ruang II, maka agar 5, bayangannya di ruang III. Kalau benda di ruang I, ruang bayangannya adalah IV, benda di ruang III, tentunya bayangannya di ruang II.
Untuk memperkirakan sifat bayangan, perhatikan ketentuan berikut:
Bayangan di ruang II dan III bersifat nyata, terbalik.
Bayangan di ruang IV bersifat maya, tegak.
Diperbesar atau diperkecilnya?
Benda di ruang II, bayangan di ruang III, dari II menjadi III, kan membesar angkanya, berarti bayangannya diperbesar.
Benda di ruang III, bayangan di ruang II, dari III menjadi II, kan mengecil, berarti bayangannya diperkecil.
Begitu juga jika benda di ruang I, bayangannya akan bersifat diperbesar.
Kembali ke soal di atas, fokus cermin F = 12 cm, 2F nya berarti 24 cm, sementara bendanya di 15 cm, berarti benda di ruang II. Bayangannya di ruang III, sehingga sifanya adalah nyata, terbalik dan diperbesar.
Soal No. 4
Sebuah benda berada 8 cm dari sebuah cermin cembung yang memiliki fokus 12 cm. Tanpa perhitungan, tentukan sifat bayangannya!
Pembahasan
Cermin cembung selalu menghasilkan bayangan yang bersifat : maya, tegak dan diperkecil. Jadi sifatnya adalah ya itu tadi.
Soal No. 5
Bayangan maya yang dibentuk oleh sebuah cermin cekung tiga kali lebih besar dari bendanya. Bila jarak fokus cermin 30 cm, maka jarak benda di depan cermin adalah....
A. 5 cm
B. 10 cm
C. 20 cm
D. 30 cm
E. 40 cm
(Dari soal ebtanas 1996)
Pembahasan
Data soal:
Cermin cekung:
s' = −3s (Maya, 3 kali lebih besar)
f = 30 cm
s =..............
Dari rumus dasarnya

Soal No. 6
Bayangan nyata yang dibentuk oleh sebuah cermin cekung tiga kali lebih besar dari bendanya. Bila jarak fokus cermin 30 cm, tentukan jarak benda dari cermin.
Data soal:
Cermin cekung:
s' = 3s (Nyata, 3 kali lebih besar)
f = 30 cm
s =..............
Dari rumus dasarnya

Soal No. 7
Sebuah cermin cembung ditempatkan di tikungan jalan. Ketika terdapat benda yang jaraknya 2 m dari cermin, bayangan yang terbentuk 1/16 kali tinggi benda. Jarak fokus cermin adalah...
A. 2/15 m
B. 2/17 m
C. 5/8 m
D. 15/2 m
E. 17/2 m
Pembahasan
Data:
Cermin cembung,
s = 2 m
M = 1/16
s' = − 1/16 × 2 = − 2/16 = − 1/8 m
(Tanda minus diberikan karena bayangan cermin cembung maya.)
Jarak fokusnya
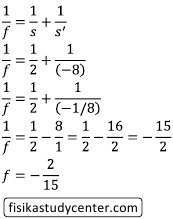
Soal No. 8
Benda setinggi 3 cm diletakkan pada jarak 10 cm di depan cermin cekung yang berjari-jari kelengkungan 10 cm. Sifat bayangan benda adalah.....
A. nyata, terbalik, setinggi 3 cm
B. nyata, terbalik, diperbesar
C. nyata, terbalik, diperkecil
D. maya, tegak, setinggi 3 cm
E. maya, tegak, diperbesar
Pembahasan
Data:
s = 10 cm
R = 10 cm
f = 5 cm
Sifat bayangan............
Benda yang diletakkan pada titik pusat cermin cekung akan menghasilkan bayangan yang letaknya di titik pusat kelengkungan cermin juga dengan sifat nyata, terbalik dan sama besar. Sehingga tinggi bayangan benda tetap 3 cm.
Jawaban: A. nyata, terbalik, setinggi 3 cm
Soal No. 9
Benda setinggi h diletakkan pada jarak 4,125 cm di depan cermin cekung yang berjari-jari kelengkungan 14,5 cm. Sifat bayangan benda adalah.....
A. nyata, tegak, setinggi h
B. nyata, terbalik, diperbesar
C. nyata, tegak, diperkecil
D. maya, tegak, setinggi h
E. maya, tegak, diperbesar
Pembahasan
f = 1/2(14,5) = 7,25 cm
s = 4,125 cm
Terlihat bahwa benda di ruang I, bayangan berada di ruang IV, sehingga sifat bayangannya maya, tegak, diperbesar. Jawaban E.
Soal No. 10
Jika benda nyata diletakkan pada jarak lebih kecil dari f di depan cermin cekung, bayangan yang terjadi bersifat...
A. maya, tegak, diperbesar
B. maya, terbalik, diperbesar
C. maya, terbalik, diperkecil
D. nyata, tegak, diperkecil
E. nyata, terbalik, diperkecil
Untuk rumus-rumus kedua cermin lengkung di atas, disini disatukan saja sebagai berikut dan perhatikan ketentuan-ketentuan yang digunakan:
Jarak titik fokus, jarak bayangan dan jarak benda.

dimana:
s = jarak benda
s' = jarak bayangan
f = jarak titik api atau titik fokus cermin
Sedangkan untuk perbesaran bayangan

dimana
M = perbesaran bayangan
h = tinggi bendanya
h' = tingg bayangannya
Perhatikan juga ketentuan yang dipakai:

Catatan:
Untuk lensa, berlaku kebalikannya. Jadi lensa cembung fokusnya positif, lensa cekung negatif. Sementara untuk letak bendanya

Soal No. 1
Sebuah benda yang tingginya 4 cm berada 8 cm di depan sebuah cermin cekung. Jika panjang jari-jari kelengkungan cermin cekung 12, tentukan:
a) jarak bayangan
b) perbesaran bayangan
c) tinggi bayangan
d) sifat bayangan
Pembahasan
Jarak titik fokus adalah setengah dari jari-jarinya.
Data:
Cermin Cekung
f = 1/2 × 12 = 6 cm
s = 8 cm
h = 4 cm
a) jarak bayangan
Masukkan datanya

Atau dengan rumus yang sudah jadi

b) perbesaran bayangan

c) tinggi bayangan
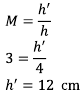
d) sifat bayangan
- nyata (s' bertanda positif)
- terbalik
- terletak di depan cermin
- diperbesar (karena M > 1)
Soal No. 2
Sebuah benda diletakkan di depan cermin cembung sejauh 20 cm yang jarak fokusnya 30 cm. Letak dan sifat bayangan yang dibentuk cermin tersebut adalah....
A. 60 cm di depan cermin, maya, tegak
B. 60 cm di belakang cermin, nyata, tegak
C. 60 cm di depan cermin, nyata, tegak
D. 12 cm di belakang cermin, maya, tegak
E. 12 cm di depan cermin, nyata, tegak
Pembahasan
Data soal:
Cermin cembung.
f = − 30 cm
s = 20 cm
Menemukan jarak bayangan dulu beserta tandanya:

atau

s' bertanda negatif, sehingga maya, tegak. Jaraknya 12 cm di belakang cermin. Jawaban D.
Soal No. 3
Sebuah benda berada 15 cm di depan cermin cekung yang memiliki titik fokus sejauh 12 cm. Dengan metode penomoran ruang, tentukan sifat-sfat bayangan yang terbentuk!
Pembahasan
Metode penomoan ruang digunakan untuk cermin cekung, dan lensa cembung. Berikut penjelasannya:

Untuk gambar ini, bagian depannya di sebelah kiri, belakangnya sebelah kanan.
Antara titik O dan titik F adalah ruang I
Antara titik F dan titik 2F adalah ruang II
Setelah titik 2F ke sana lagi adalah ruang III
Ruang IV berada di seberang, lihat gambar di atas.
Jumlah nomor ruang tempat benda dengan nomor ruang tempat bayangan adalah lima. Misalkan benda di ruang II, maka agar 5, bayangannya di ruang III. Kalau benda di ruang I, ruang bayangannya adalah IV, benda di ruang III, tentunya bayangannya di ruang II.
Untuk memperkirakan sifat bayangan, perhatikan ketentuan berikut:
Bayangan di ruang II dan III bersifat nyata, terbalik.
Bayangan di ruang IV bersifat maya, tegak.
Diperbesar atau diperkecilnya?
Benda di ruang II, bayangan di ruang III, dari II menjadi III, kan membesar angkanya, berarti bayangannya diperbesar.
Benda di ruang III, bayangan di ruang II, dari III menjadi II, kan mengecil, berarti bayangannya diperkecil.
Begitu juga jika benda di ruang I, bayangannya akan bersifat diperbesar.
Kembali ke soal di atas, fokus cermin F = 12 cm, 2F nya berarti 24 cm, sementara bendanya di 15 cm, berarti benda di ruang II. Bayangannya di ruang III, sehingga sifanya adalah nyata, terbalik dan diperbesar.
Soal No. 4
Sebuah benda berada 8 cm dari sebuah cermin cembung yang memiliki fokus 12 cm. Tanpa perhitungan, tentukan sifat bayangannya!
Pembahasan
Cermin cembung selalu menghasilkan bayangan yang bersifat : maya, tegak dan diperkecil. Jadi sifatnya adalah ya itu tadi.
Soal No. 5
Bayangan maya yang dibentuk oleh sebuah cermin cekung tiga kali lebih besar dari bendanya. Bila jarak fokus cermin 30 cm, maka jarak benda di depan cermin adalah....
A. 5 cm
B. 10 cm
C. 20 cm
D. 30 cm
E. 40 cm
(Dari soal ebtanas 1996)
Pembahasan
Data soal:
Cermin cekung:
s' = −3s (Maya, 3 kali lebih besar)
f = 30 cm
s =..............
Dari rumus dasarnya

Soal No. 6
Bayangan nyata yang dibentuk oleh sebuah cermin cekung tiga kali lebih besar dari bendanya. Bila jarak fokus cermin 30 cm, tentukan jarak benda dari cermin.
Data soal:
Cermin cekung:
s' = 3s (Nyata, 3 kali lebih besar)
f = 30 cm
s =..............
Dari rumus dasarnya

Soal No. 7
Sebuah cermin cembung ditempatkan di tikungan jalan. Ketika terdapat benda yang jaraknya 2 m dari cermin, bayangan yang terbentuk 1/16 kali tinggi benda. Jarak fokus cermin adalah...
A. 2/15 m
B. 2/17 m
C. 5/8 m
D. 15/2 m
E. 17/2 m
Pembahasan
Data:
Cermin cembung,
s = 2 m
M = 1/16
s' = − 1/16 × 2 = − 2/16 = − 1/8 m
(Tanda minus diberikan karena bayangan cermin cembung maya.)
Jarak fokusnya
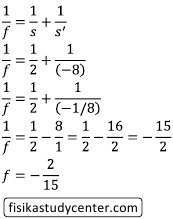
Soal No. 8
Benda setinggi 3 cm diletakkan pada jarak 10 cm di depan cermin cekung yang berjari-jari kelengkungan 10 cm. Sifat bayangan benda adalah.....
A. nyata, terbalik, setinggi 3 cm
B. nyata, terbalik, diperbesar
C. nyata, terbalik, diperkecil
D. maya, tegak, setinggi 3 cm
E. maya, tegak, diperbesar
Pembahasan
Data:
s = 10 cm
R = 10 cm
f = 5 cm
Sifat bayangan............
Benda yang diletakkan pada titik pusat cermin cekung akan menghasilkan bayangan yang letaknya di titik pusat kelengkungan cermin juga dengan sifat nyata, terbalik dan sama besar. Sehingga tinggi bayangan benda tetap 3 cm.
Jawaban: A. nyata, terbalik, setinggi 3 cm
Soal No. 9
Benda setinggi h diletakkan pada jarak 4,125 cm di depan cermin cekung yang berjari-jari kelengkungan 14,5 cm. Sifat bayangan benda adalah.....
A. nyata, tegak, setinggi h
B. nyata, terbalik, diperbesar
C. nyata, tegak, diperkecil
D. maya, tegak, setinggi h
E. maya, tegak, diperbesar
Pembahasan
f = 1/2(14,5) = 7,25 cm
s = 4,125 cm
Terlihat bahwa benda di ruang I, bayangan berada di ruang IV, sehingga sifat bayangannya maya, tegak, diperbesar. Jawaban E.
Soal No. 10
Jika benda nyata diletakkan pada jarak lebih kecil dari f di depan cermin cekung, bayangan yang terjadi bersifat...
A. maya, tegak, diperbesar
B. maya, terbalik, diperbesar
C. maya, terbalik, diperkecil
D. nyata, tegak, diperkecil
E. nyata, terbalik, diperkecil
Kamis, 07 April 2016
Materi Kimia SMA Kelas X
REAKSI REDOKS
Redoks
Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.
Oksidator dan reduktor
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai oksidator atau agen oksidasi. Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya sendiri tereduksi. Oleh karena ia “menerima” elektron, ia juga disebut sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin).Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai reduktor atau agen reduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia “mendonorkan” elektronnya, ia juga disebut sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik[1][2], terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai pasangan redoks.
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
 hidrogen fluorida:
hidrogen fluorida:Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi. Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian atom dalam senyawa.Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Contoh-contoh lainnya
- Besi(II) teroksidasi menjadi besi(III)
- hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
- H2O2 + 2 e− → 2 OH−
- 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
- 2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
- 4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel peleburan.Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari sel elektrokimia.
Reaksi redoks dalam biologi
 |
 |
Atas: asam askorbat (bentuk tereduksi Vitamin C)
Bawah: asam dehidroaskorbat (bentuk teroksidasi Vitamin C)
Bawah: asam dehidroaskorbat (bentuk teroksidasi Vitamin C)
Pernapasan sel, contohnya, adalah oksidasi glukosa (C6H12O6) menjadi CO2 dan reduksi oksigen menjadi air. Persamaan ringkas dari pernapasan sel adalah:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- Proses pernapasan sel juga sangat bergantung pada reduksi NAD+ menjadi NADH dan reaksi baliknya (oksidasi NADH menjadu NAD+). Fotosintesis secara esensial merupakan kebalikan dari reaksi redoks pada pernapasan sel:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
Istilah keadaan redoks juga sering digunakan untuk menjelaskan keseimbangan antara NAD+/NADH dengan NADP+/NADPH dalam sistem biologi seperti pada sel dan organ. Keadaan redoksi direfleksikan pada keseimbangan beberapa set metabolit (misalnya laktat dan piruvat, beta-hidroksibutirat dan asetoasetat) yang antarubahannya sangat bergantung pada rasio ini. Keadaan redoks yang tidak normal akan berakibat buruk, seperti hipoksia, guncangan (shock), dan sepsis.
Siklus redoks
Berbagai macam senyawa aromatik direduksi oleh enzim untuk membentuk senyawa radikal bebas. Secara umum, penderma elektronnya adalah berbagai jenis flavoenzim dan koenzim-koenzimnya. Seketika terbentuk, radikal-radikal bebas anion ini akan mereduksi oskigen menjadi superoksida. Reaksi bersihnya adalah oksidasi koenzim flavoenzim dan reduksi oksigen menjadi superoksida. Tingkah laku katalitik ini dijelaskan sebagai siklus redoks.Contoh molekul-molekul yang menginduksi siklus redoks adalah herbisida parakuat, dan viologen dan kuinon lainnya seperti menadion. [3]PDF (2.76 MiB)
Menyeimbangkan reaksi redoks
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan penyeimbangan komponen-komponen dalam reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion H+, ion OH–, H2O, dan elektron untuk menutupi perubahan oksidasi.Media asam
Pada media asam, ion H+ dan air ditambahkan pada reaksi setengah untuk menyeimbangkan keseluruhan reaksi. Sebagai contoh, ketika mangan(II) bereaksi dengan natrium bismutat:Media basa
Pada media basa, ion OH– dan air ditambahkan ke reaksi setengah untuk menyeimbangkan keseluruhan reaksi.Sebagai contoh, reaksi antara kalium permanganat dan natrium sulfit:-
Reaksi Reduksi Oksidasi (Redoks)
14 04 2010 Setelah
mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan
konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama
senyawa serta penerapannya.
Setelah
mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan
konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama
senyawa serta penerapannya.
Materi pelajaran KIMIA Kelas X Semester 2, Oleh Gianto,SPd
A. PENGERTIAN REDUKSI OKSIDASI
Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen (besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis sebagai berikut.

Pada reaksi tersebut, besi mengalami oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan cara direaksikan dengan gas hidrogen, persamaan reaksinya:


Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa pelepasan elektron dinamakan oksidasi, sedangkan peristiwa penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa perkaratan besi dapat dijelaskan dengan reaksi berikut:
 Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh karena
itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada setiap
persamaan reaksi, massa dan muatan harus setara antara ruas
kanan dan ruas kiri (ingat kembali penulisan persamaan reaksi).
Persamaan reaksi redoks tersebut memiliki muatan dan jumlah atom yang
sama antara ruas sebelah kiri dan sebelah kanan persamaan reaksi.
Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau oksidator. Sebaliknya, zat yang dapat mereduksi zat lain dinamakan zat pereduksi atau reduktor. Pada Contoh diatas, Magnesium melepaskan elektron yang menyebabkan klorin mengalami reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator

Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Bagaimana bilangan oksidasi dapat menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3. Reaksinya dapat dituliskan sebagai berikut :

Jika dikaji berdasarkan konsep pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi. Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer elektron, tetapi terjadi penggunaan bersama pasangan elektron membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun transfer elektron maka para pakar kimia mengembangkan konsep alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini, jika dalam reaksi bilangan oksidasi atom meningkat maka atom tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam pereaksi maupun hasil reaksi.

Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2 disebut reduktor.
Contoh Reaksi Redoks Menurut Perubahan Bilangan Oksidasi

Langganan:
Komentar (Atom)





























